| 一、 主要试剂与标定 氯化钠(或氯化钾):20%水溶液 二苯胺磺酸钠指示剂:0.5%水溶液,加1~2滴硫酸(1+1)。 重铬酸钾标准溶液(0.05000N):准确称取2.4516克经研细并在150~170℃干燥的优级纯重铬钾于烧杯中,用水溶解后移入1 升容量瓶中,用水稀至刻度,摇匀。此溶液浓度为0.05000N,无需再进行标定。 如无优级纯重铬酸钾,则可按下述操作来标定:准确称取0.1500克经干燥的优级纯氧化铁(Fe2O3)于烧杯中,加30毫升盐酸(1+I)。微微加热溶解,趁热滴加氯化亚锡溶液(15%)至黄色恰巧消失,再过量1~2滴,冷却。加10毫升氯化高汞饱和溶液,此时应有丝状沉淀析出,放置2~5分钟,用水稀释至约200毫升,10毫升硫磷混合酸及数滴二苯胺磺酸钠指示剂,然后用重铬酸钾标准溶液滴定至紫色即为终点。 计算: NK2Cr2O7= 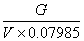 式中:――重铬酸钾标准溶液的当量浓度; G――氧化铁(Fe2O3)重,克; V――滴定时消耗重铬酸钾标准溶液的毫升数。 硫酸亚铁标准溶液(0.05N):称取20克硫酸亚铁铵于600毫升烧杯中,加入300毫升水和100毫升硫酸,溶解后移入1升容瓶中,用水稀释至刻度,摇匀。使用时标定。 在盛有50毫升硫酸(1+99)的250毫升烧杯中,用滴定管准确加入40.00毫升0.05N硫酸亚铁标准溶液,加5毫升磷酸,6滴二苯胺磺酸钠指示剂,用0.05000N重铬酸钾标准溶液滴定至溶液由绿色变为紫争即为终点。 计算:NFeSO4= 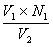 式中:NFeSO4―硫酸亚铁标准溶液的当量浓度; V2――加入的硫酸亚铁标准溶液的毫升数; V1――滴定时消耗重铬酸钾标准溶液的毫升数; N1――重铬酸钾标准溶液的当量浓度。 二、 操作步骤 [方法一] 称取0.5克分析样品于石英坩埚内,经电热炉上低温加热蒸发除去有机挥发物,并渐渐升高温度,炭化,置于800℃马弗炉(或煤气灯中火加热)灼烧半小时,冷却。用10毫升王水,分二次加热溶解,将溶液与不溶物一起洗入250毫升烧杯中,加5滴20%氯化钠溶液,加热煮沸数分钟后,用水吹洗杯壁,于低温蒸发近干,再用水吹洗杯壁,蒸发至近于,加5毫升盐酸和少许水,微热溶解,冷却。加50毫升硫酸(1+99),在充分搅拌下准确加入0.05N硫酸亚铁标准溶液(视金的含量加入,并过量2~5毫升),放置10分钟,加6滴0.5%二苯胺磺酸钠指示剂,5毫升磷酸,用0.05000N重铬酸钾标准溶液回滴,溶液由绿色变化为紫色为终点。 计算: Au%=  ×100 ×100 式中: V1、V2――分别表示硫酸亚铁和重铬酸钾标准溶液的毫升数; N1、N2――分别表示硫酸亚铁和重铬酸钾标准溶液的当量浓度; G――试样重,克; 0.06566――金的毫克当量。 [方法二] 称取0.5克分析样品于已恒重的石英坩埚中,经电热炉上低温蒸发除去有机发检察署物,并渐渐升温灰化,置800℃马弗炉(或煤气灯中火加热)灼烧半小时,称至恒重。 计算: Au%= 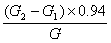 ×100 ×100 式中:G1――灼烧前坩埚重,克; G2――灼烧后坩埚重,克; G――试样重,克; 0.94――校正系数。 三、 结果与讨论 [AuCl4]- /Au标准氧化还原电位为+0.989伏,Fe+3/Fe+2标准氧化还原电位为+0.77伏,两者相差甚大,因此,在酸性溶液中亚铁离子能定量还原金为胶体元素金悬浮在溶液中。可利用此化学反应,加入过量亚铁溶液,使Au+3被Fe+2离子还原为金属后,用标准重铬酸钾溶液回滴剩余的亚铁,而计算金的含量。 Fe+2+Au+3→ Fe+3+ 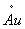 6Fe+2+Cr2O7-2+14H+→ 6Fe+3+2Cr+3+7H2O Se 、Ni、 Pb、 Ag、 Zn、 Fe、 Bi等元素存在对本法测定不影响。针对本样品情况,样品作去机物和灰化之后,可直接进行测定。反应后生成 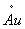 过滤回收。 过滤回收。 I)金是最易被还原的元素,灼烧金的化合物即可分解为金属。蒸发三价金的氯铬合酸,甚至在水浴上进行,也可部分分解为一价和金属金。但氯金酸钾(钠)较稳定,所以在分析溶液中加入一定量钠和钾离子,以防金的还原。但在低温蒸发至干,仍要发生金被还原,务须注意。 王水在蒸发时产生氯亚硝酰(NOCl),当用水稀释时能还原三价金,并还影响滴定终点观察。因此,需要用盐酸赶尽硝酸。在实验过程中发现溶液中存在一定量盐酸,反使滴定终点变化明显(见表1)。 如果加入4毫升盐酸和0.5克NH4Cl可消除一定量Pd的干扰,应用于白金水中对Au的测定(见表2)。 ii)在酸性溶液中亚铁离子能还原金为胶体元素金,实验证明了,当还原时间为10分钟时(室温),亚铁离子过量5~150%都能定量还原,结果见表3。 iii)根据我们所拟制方法共分析了十六试样,个别试样进行原子吸收光谱法和重量法校对,结果满意。本方法的标准偏差(S)为0.084,相对标准偏差(RSD)为0.85%,结果见表4。 iv)样品经高温灼烧,除去了有机物,金分解为金属金,以及其它金属元素(或其氧化物)留下,在工艺条件不变情况下,除了金以外,其它金属元素其量应为恒值,因此,我们企图通过校正系数法来建快速、简便分析方法测定其金的含量是有可能的,我们测定了19只分析样品,求得校正系数为0.94。 通过样品灼烧后残渣重乘其校正系数(0.94)求得样品中金实际含量,其结果与容量分析方法相符,标准偏差为0.08,相对标准偏差为1.1% ,结果见表5。 表1 盐 酸 量 对 测 定 影 响 已知含Au % | 溶液状态 | 加入HCl(毫升) | 测得Au % | 终点观察 | 11.24 | 蒸发至近干 | ― | 11.25 | 终点突变明显 | 11.24 | 蒸发至近干 | 2.00 | 11.26 | 终点突变明显 | 11.24 | 蒸发至近干 | 4.00 | 11.25 | 终点突变明显 |
表2 白 金 水 中 金 的 测 定 方 法 | 加入HCl (毫升) | 加入NH4Cl (克) | 终点观察 | 测得Au % | 本 方 法 | 4 | 0.5 | 终点变化明显 | 6.33,6.30 6.22,6.28 | 本 方 法 | ― | 0.5 | 终点变化不明显 | ― | 原子吸收光谱法 | ― | ― | ― | 6.19 | 重量法(草酸还原) | ― | ― | ― | 6.27 |
表3 亚 铁 用 量 对 金 还 原 影 响 加 入 量Au (毫克) | Fe++ 过 量 数 (%) | 回 收 量Au (毫克) | 回 收 率 (%) | 72.62 | 151 | 72.56 | 99.92 | 72.62 | 70 | 72.56 | 99.92 | 97.70 | 60 | 97.79 | 100.09 | 63.84 | 56 | 63.84 | 100.00 | 55.19 | 40 | 55.09 | 99.82 | 60.12 | 35 | 60.18 | 100.10 | 49.33 | 30 | 49.38 | 100.10 | 58.03 | 30 | 57.93 | 99.83 | 61.05 | 20 | 61.26 | 100.34 | 67.87 | 20 | 68.23 | 100.53 | 61.49 | 10 | 61.28 | 99.66 | 66.47 | 5 | 66.36 | 99.83 |
表4 实 际 样 品 分 析
|

